February 8, 2023
Von Allison Strochlic und Merrick Kossack
Am 12. Januar 2023 veranstalteten Merrick Kossack und Allison Strochlic, Research Directors des Human Factors Research & Design (HFR&D)-Teams von Emergo by UL, ein Webinar, um den neuen Leitlinienentwurf der US-amerikanischen Food and Drug Administration (FDA) vom 9. Dezember 2022 vorzustellen und näher zu erläutern. Der Leitlinienentwurf mit dem Titel Content of Human Factors Information in Medical Device Marketing Submissions (Inhalt der Human-Factors-Informationen in Anträgen für das Inverkehrbringen von Medizinprodukten) erläutert, welche HF-Informationen Hersteller in einen Antrag für das Inverkehrbringen aufnehmen müssen, einschließlich 510(k), PMA-Anträge und andere. Sobald die endgültige Version feststeht, werden diese Leitlinien den Leitlinienentwurf mit dem Titel „List of Highest Priority Devices for Human Factors Review“ (Liste der Produkte mit höchster Priorität für die Human-Factors-Prüfung) von 2016 ersetzen. Dabei ist vor allem klarzustellen, dass dieser neue Leitlinienentwurf zwar den HF-Mindestinhalt in einem Antrag angibt, die von der FDA im Februar 2016 veröffentlichte HFE-Leitlinie mit dem Titel Applying Human Factors and Usability-Engineering to Medical Devices (Human Factors Engineering und Gebrauchstauglichkeit Engineering für Medizinprodukte einsetzen) jedoch weiterhin Bestand hat und die wichtigsten HF-Aktivitäten beschreibt, die in der Medizintechnik während der Produktentwicklung ausgeführt werden müssen.
Die wichtigsten Fragen von den Teilnehmern an unserem FDA-HFE-Webinar
Während unseres Live-Webinars erhielten wir von den Teilnehmern Dutzende von Fragen über die Nuancen der neuen Leitlinien und wie sich diese auf ihre aktuellen Entwicklungsbemühungen auswirken können. Wir nehmen an, dass andere ähnliche Fragen haben, und umreißen hier kurz einige der am häufigsten gestellten Fragen und unsere Antworten:
Frage: Was halten Sie davon, im HF-Report die vollständige uFMEA aufzunehmen oder auf ein separates Risikomanagementdokument zu verweisen, anstatt den spezifizierten Inhalt der nutzungsbezogenen Risikoanalyse (URRA) aufzunehmen?
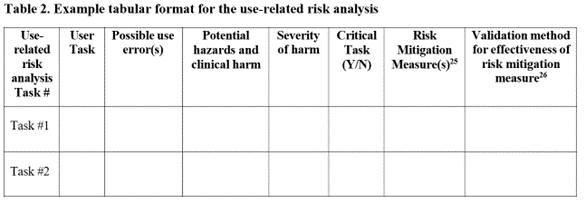
Antwort: Auf der Grundlage des neuen Leitlinienentwurfs (Zeilen 365-371) empfehlen wir, die URRA-Informationen wie angefordert einzureichen, idealerweise im Format Tabelle 2 des Leitfadens für den Mindestinhalt, anstatt die vollständige uFMEA einzureichen (oder einfach darauf zu verweisen). Während die Informationen zusammenhängen – wobei die URRA aus der uFMEA (und HFE-fokussiert) ist – glauben wir, dass die HF-Prüfer der Agentur in erster Linie an der Teilmenge der Informationen aus einer umfassenden uFMEA interessiert sind, die sich auf die Identifizierung kritischer Aufgaben bezieht. Die angeforderte Einreichung der URRA wird wahrscheinlich dazu beitragen, unnötige Verzögerungen zu vermeiden, da der Prüfer nicht in der Lage ist, die wichtigsten anwendungsbezogenen Risikoinformationen schnell zu finden und sich darauf zu konzentrieren. Unten finden Sie Tabelle 2, wie sie im neuen Leitlinienentwurf der FDA dargestellt ist.
Frage: Können Sie die neue Definition von "ernsthaftem Schaden" näher erläutern? Wird diese Definition dazu führen, dass bereits bestehende kritische Aufgaben herabgestuft oder deklassifiziert werden, da "schwerwiegender Schaden" nun auch Todesfälle einschließt?
Antwort: Unsere Interpretation des neuen Leitlinienentwurfs ist, dass "ernsthafter Schaden" schwere Verletzungen ODER Tod umfasst. Daher erwarten wir nicht, dass kritische Aufgaben herabgestuft werden, nur weil sie kein Todesrisiko darstellen. Beachten Sie, dass, obwohl dieser neue Leitlinienentwurf "ernsthaften Schaden" als "sowohl schwere Verletzungen als auch Tod umfasst" definiert, wir glauben, dass die Absicht "schwere Verletzung ODER Tod" ist, wobei darauf hingewiesen wird, dass eine Aufgabe zu ersterem führen kann, aber nicht zu letzterem.
Frage: Wenn ein Produkt in Europa mit der CE-Kennzeichnung versehen wurde, aber noch nicht zur Marktzulassung oder Zulassung bei der FDA eingereicht wurde, wird das Produkt dann im Zusammenhang mit den neuen Leitlinien und dem beigefügten Flussdiagramm als neues oder modifiziertes Produkt betrachtet?
Antwort: Wir gehen davon aus, dass ein solches Gerät aus Sicht der FDA als neues Gerät betrachtet wird, da die Verantwortung der FDA für die Freigabe und Zulassung von Produkten für den US-Markt und ihr Fokus auf den US-Markt und die US-Bürger in HFE und anderen Leitlinien anerkannt wird. Während Sie in Ihrem Antrag Ergebnisse aus HF-Analysen und -Bewertungen, die außerhalb der USA durchgeführt wurden, sowie alle Überwachungsdaten nach dem Inverkehrbringen in Ihren Antrag aufnehmen könnten und sollten, würde die FDA wahrscheinlich auch relevante HF-Informationen aus den USA (z. B. HF-Validierungstestdaten von US-Teilnehmern) erwarten, wenn es sich um kritische Aufgaben handelt.
Frage: In welchem Bezug stehen die neuen Leitlinien zu der FDA-Leitlinie, wann ein 510(k)-Antrag für eine Änderung an einem bestehenden Produkt einzureichen ist?
Antwort: Der FDA-Leitfaden von 2017 mit dem Titel "Decision, When to Submit a 510(k) for a Change to an Existing Device (Entscheiden, wann ein 510(k) für eine Änderung an einem vorhandenen Gerät eingereicht werden soll, soll Herstellern dabei helfen, festzustellen, wann eine Änderung an einem bestehenden Produkt die Einreichung eines neuen 510(k) rechtfertigt. Im neuen Leitlinienentwurf 2022 (Zeilen 282-283) heißt es: "[Abschnitt V] beschreibt die HF-Informationen, die für die Einreichung bei der FDA in einem Zulassungsantrag geeignet sein können, wenn eine solche erforderlich ist", und verweist auf Fußnote 27, in der die Entscheidung zitiert wird, wann ... Beratung. Wir interpretieren dies so, dass Sie, wenn Sie gemäß diesem Leitfaden von 2017 feststellen, dass Sie einen neuen 510(k) für Ihr modifiziertes Gerät einreichen müssen, die angeforderten Mindest-HF-Informationen im Zusammenhang mit der richtigen HF-Einreichungskategorie gemäß dem Flussdiagramm in den neuen Leitlinienentwurf 2022 aufnehmen sollten.
Wir gehen davon aus, dass der neue Leitlinienentwurf – ob in seiner aktuellen Form oder wenn er endgültig ist – den Herstellern helfen wird, zu bestimmen, welche HF-Informationen bei der FDA eingereicht werden müssen, insbesondere für Unternehmen, die das Design eines bestehenden Geräts ändern. Sehr wichtig (so sehr, dass Sie diesen Satz vielleicht noch einmal lesen möchten), unabhängig davon, ob Ihr Gerät in der HF-Einreichungskategorie 1, 2 oder 3 landet, glauben wir, dass die FDA immer noch von den Herstellern erwartet, dass sie gemäß ihrer endgültigen Prozessanleitung von 2016 ordnungsgemäße HF-Arbeiten durchführen, um sicherzustellen, dass ein Gerät sicher und effektiv verwendet werden kann, und dass es den Bedürfnissen der Benutzer entspricht.
Wenn Sie das Webinar nicht live verfolgt haben oder es sich noch einmal ansehen möchten, klicken Sie auf folgenden Link: Neue US FDA-Leitlinie zu HFE für Medizinprodukte. Bei Fragen können Sie sich gerne an uns wenden. Gerne sind wir Ihnen auch behilflich, die Auswirkungen dieser neuen Leitlinien dahingehend zu bewerten, welche HF-Informationen Sie in Ihren Antrag aufnehmen müssen.
Fordern Sie mehr Informationen von unseren Experten an.
Vielen Dank für Ihr Interesse an unseren Produkten und Beratungs-Dienstleistungen. Um Sie mit dem passenden Ansprechpartner verbinden zu können, benötigen wir einige Informationen von Ihnen.