February 8, 2023
작성자: Allison Strochlic 및 Merrick Kossack
2023년 1월 12일에 Emergo by UL의 인간 공학 연구 & 설계(HFR&D) 팀의 연구 책임자인 Merrick Kossack과 Allison Strochlic은 미국 식품의약청(FDA)이 2022년 12월 9일에 발행한 신규 FDA HFE 지침을를 소개하고 고찰하기 위해 웨비나를 주관했습니다. 이 신규 FDA HFE 지침 문서, 즉 의료기기 시판 제출물의 인간 공학 정보 내용은 510k, PMA 등을 포함하여 제조업체가 시판 제출물에 명시해야 하는 인간 공학(HF) 정보를 약술합니다. 이 지침은 일단 확정되면 2016년 초안 지침인 "인간 공학 요소 검토에 대한 가장 최우선 기기의 목록"을 대체합니다. 한 가지 주요 설명에 따르면, 이러한 새 초안 지침은 제출물 내 최소 HF 내용을 명시하는 반면 FDA가 2016년 2월에 발행한 신규 FDA HFE 지침인 의료기기에 인간 공학 및 사용성 엔지니어링 적용은 여전히 기기 개발 중에 수행할 주요 HF 활동을 요약한다는 점입니다.
당사가 주관한 신규 FDA HFE 지침 관련 웨비나 참석자의 주요 질문
라이브 웨비나에서 당사는 신규 FDA HFE 지침의 미묘한 차이와 해당 지침이 진행 중인 개발 노력에 미치는 영향에 관해 참석자로부터 수십 건의 질문을 받았습니다. 다른 사람들도 비슷한 질문을 할 수 있다고 가정하여 가장 일반적인 질문과 답변을 아래에 간략하게 알려드리겠습니다.
질문: HF 보고서에서 지정된 사용 관련 위험 분석(URRA) 내용을 포함하는 것이 아니라 완전한 uFMEA를 포함하거나 별도의 위험 관리 문서를 참조하는 것에 대해 어떻게 생각하나요?
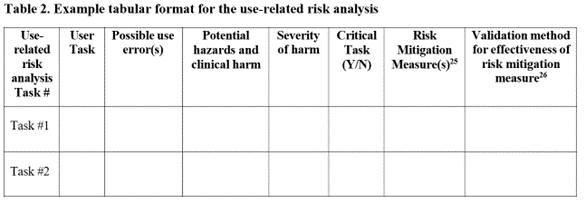
답변: 신규 FDA HFE 지침(365-371행)에 따라 전체 uFMEA를 제출(또는 단순히 참조)하는 대신 최소 콘텐츠에 대한 지침의 표 2 형식을 이상적으로 따르는 요청에 따라 URRA 정보를 제출할 것을 권장합니다. uFMEA에서 발췌한 URRA(HFE 중심)와 함께 정보가 관련되어 있지만 주무기관의 HF 검토 담당자는 중요한 작업 식별과 관련된 포괄적인 uFMEA의 정보 하위 집합에 주로 관심이 있다고 생각합니다. 요청에 따라 URRA를 제출하면 검토 담당자가 주요 사용 관련 위험 정보를 신속하게 찾아 집중할 수 없기 때문에 불필요한 지연을 피하는 데 도움이 될 것입니다. 신규 FDA HFE 지침문서에 제시된 표 2는 아래를 참조하세요.
질문: "심각한 피해"에 대한 새로운 정의를 자세히 설명해 줄 수 있나요? "심각한 피해"에는 이제 사망이 포함되기 때문에 이 정의로 인해 기존의 중요한 작업의 강등이나 기밀취급 해제가 발생하나요?
답변: 신규 FDA HFE 지침에 대한 당사의 해석은 "심각한 피해"에 중상 또는 사망이 포함된다는 것입니다. 따라서 단순히 사망 위험을 야기하지 않는다는 이유로 중요한 작업이 강등될 것으로 예상하지 않습니다. 새로운 초안 지침에서는 "심각한 피해"를 "중상과 사망이 모두 포함되는 것"으로 정의하지만, 당사는 작업이 전자를 야기할 수 있지만 후자를 야기하지 않는다는 점에 주목하면서 그 의도가 "중상 또는 사망"이라고 생각합니다.
질문: 기기가 유럽에서 CE 마크를 받았지만 FDA의 시장 허가나 승인을 위해 아직 제출되지 않은 경우, 새로운 지침 및 포함된 플로우차트의 맥락에서 기기를 새로운 기기 또는 개량 기기 중 어떤 것으로 간주하나요?
답변: 당사는 FDA가 제품에 대해 미국 시장 판매를 허가 및 승인해야 하는 책임이 있고 HFE 및 기타 지침에서 미국 시장과 미국 거주민을 집중적으로 다루기 때문에 FDA 관점에서 보면 그러한 기기가 새 기기로 간주된다고 예상합니다. 귀사의 제출물뿐만 아니라 시판 후 감시 데이터에 미국 이외 국가에서 실시된 HF 분석과 평가의 연구 결과를 포함할 수 있지만(포함해야 하지만), FDA는 중요한 작업이 있는 경우 미국 기반의 관련 HF 정보(예: 미국 참여자를 대상으로 한 HF 검증 테스트 데이터)도 기대할 가능성이 높습니다.
질문: 신규 FDA HFE 지침은 FDA 지침 "기존 기기의 변경을 위해 510k를 제출하는 시점 결정"과 어떤 관련이 있나요?
답변: "기존 기기의 변경을 위한 510k를 제출하는 시점 결정" 제목의 2017년 FDA 지침은 기존 기기의 변경으로 인해 새 510k를 제출해야 하는 시점을 제조업체가 결정할 수 있도록 돕는 것을 목표로 합니다. 2022년 새로운 초안 지침(282~283행)은 "[섹션 V]에서는 요구될 때 시판 제출물을 통해 FDA에 제출하기에 적합할 수 있는 HF 정보를 설명한다"라고 명시하며, 제출 시점 결정 지침을 인용하는 각주 27을 참조합니다. 이에 대한 당사의 해석에 따르면, 귀사는 2017년 지침에 따라 개량 기기에 대해 새로운 510k를 제출해야 한다고 판단하는 경우 2022년 신규 FDA HFE 지침에 나와 있는 플로우차트에 따라 적절한 HF 제출 카테고리와 관련된 요청받은 최소 HF 정보를 포함해야 합니다.
당사는 현재 형식이든 최종이든 신규 FDA HFE 지침 초안은 기존 기기의 설계를 수정하는 회사를 비롯하여 제조업체가 어떤 HF 정보를 FDA에 제출해야 할지 결정하는 데 도움이 될 것이라고 예상합니다. 매우 중요한 사항으로(그래서 이 문장을 다시 읽고자 할 수 있습니다) 기기가 HF 제출 카테고리 1, 2 또는 3 중 어느 카테고리에 속하든지 당사는 기기가 안전하고 효과적으로 사용되고 사용자의 요구를 충족하는 것을 확인할 수 있도록 FDA가 2016년 최종 절차 지침에 따른 제조업체의 적절한 HF 작업 수행을 여전히 기대한다고 생각합니다.
라이브 웨비나에 참석하지 못했거나 이 웨비나를 다시 시청하고 싶은 경우 재시청이 가능합니다(의료기기 신규 FDA HFE 지침). 질문이 있다면 연락주시기 바랍니다. 귀사의 제출물에 어떤 HF 정보를 포함할지 결정할 때 새로운 지침의 영향을 평가할 수 있도록 당사가 도와드릴 수 있습니다.
전문가에게 자세한 정보를 요청하세요
Emergo 제품과 서비스에 관심을 가져 주셔서 감사합니다. 담당자 연결을 위해 정보를 입력해 주세요.